 ELEKTROGRAFIA
V ŠKOLSKEJ PRAXI
ELEKTROGRAFIA
V ŠKOLSKEJ PRAXI
Otto
Tomeček, Mária Lichvárová
Katedra
chémie FPV UMB v Banskej Bystrici
Elektrografia, metóda kvalitatívnej analýzy látok, je v podstate
elektrolýza osobitného druhu. Je založená na princípe elektrolytického
vylučovania katiónov kovov do roztoku elektrolytu. Uplatňuje sa na
identifikáciu kovov, kovov v zliatinách, kovov vo vodivých mineráloch
(sulfidy, arzenidy, antimonidy a ďalšie), ale aj na skúmanie povrchovej
štruktúry kovov, prípadne aj skúšanie kovových povlakov, za predpokladu, že
základný kov je menej ušľachtilý ako kovový povlak.
Elektrograf - zariadenie na elektrografickú analýzu, je veľmi jednoduché.
Základom je hliníková (olovená, uhlíková) platnička, ktorá sa spojí so záporným
pólom zdroja jednosmerného prúdu (akumulátor napätia 4-12 V alebo vrecková
batéria napätia 4,5 V). Na túto platničku, ktorá predstavuje katódu sa položí
filtračný papierik ovlhčený indiferentným elektrolytom. Na ovlhčenie postačí
jedna až tri kvapky roztoku. Najvhodnejším elektrolytom je roztok dusičnanu
draselného KNO3 (w = 5%). Môžu sa použiť aj iné roztoky látok, napr.
chlorid draselný, chlorid sodný, síran sodný, síran draselný a ďalšie. Na
tento papierik, ovlhčený elektrolytom, sa položí kúsok elektricky vodivej látky
– vzorky, ktorej zloženie sa má určiť. Na vzorku sa potom pritlačí anóda,
banánik, drôtik spojený s kladným pólom zdroja prúdu. Týmto zapojením,
vytvorením elektrického obvodu, dochádza k anodickému rozpúšťaniu vzorky,
ktorá je anódou a katióny kovu z anódy prechádzajú ku katóde
(hliníková platnička) a zachytávajú sa v elektrolyte na filtračnom
papieri. Výhodou je, že už v krátkom čase expozície (10 až 60 sekúnd) do
elektrolytu prejde dostatočné množstvo katiónov kovov na ich identifikáciu
vhodným činidlom. Po expozícií sa na takto pripravenom papieriku dokazuje
prítomnosť jednotlivých katiónov.
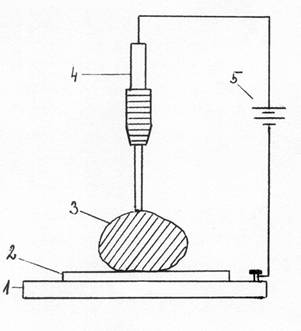
Obr.1 Schéma
elektrografu:
1-hliníková platnička,
2-filtračný papierik,
3-vzorka, 4-banánik,
5-zdroj jednosmerného prúdu.
Pri
analýzach jednoduchých látok je niekedy výhodnejšie namiesto indiferentného
elektrolytu použiť priamo identifikačné činidlo. Výsledkom analýzy je získaná
farebná škvrna, charakteristická pre dôkaz daného katiónu. Voľba vhodného
činidla je veľmi dôležitá. Musí vytvárať s daným katiónom farebnú
zlúčeninu. Niekedy je u elektrografických analýz výhodné získať jediným
exponovaním katióny na viacerých papierikoch položených na sebe. Podmienkou je kvalitné
navlhčenie všetkých papierikov elektrolytom. Prípadne sa môže použiť pásik
filtračného papierika, na ktorý sa nakvapkajú kvapky viacerých činidiel
navzájom oddelených pásikmi parafínu. Tento spôsob elektrografie je výhodný na
analýzy zliatin. Postupným prikladaním, exponovaním vzorky na jednotlivých
činidlách sa dá tak veľmi rýchlo uskutočniť celková kvalitatívna analýza
a určiť zloženie zliatiny.
Elektrografia má pre školskú prax rad výhod. V prvom rade je to jednoduchá
metóda. Zariadenie na analýzu, elektrograf sa dá ľahko zhotoviť aj svojpomocne,
z bežne prístupných materiálov. Elektrografická analýza aj zložitejších
vzoriek je veľmi rýchla. Vlastná expozícia, získanie katiónu prechodom zo
vzorky do elektrolytu trvá len niekoľko sekúnd. Rovnako vlastný dôkaz
kvapkovými reakciami. Na analýzu sa použije malé množstvo látky-vzorky
a minimálny objem roztokov činidiel. Výhodou je, že takouto analýzou sa
neporuší skúmaný predmet. Vzorka sa nemusí na analýzu pilovaním, práškovaním a rozpúšťaním
osobitne pripravovať. Takto sa môžu skúmať vzácne nádoby, archeologické
i muzeálne pamiatky a pod.
Elektrograficky sa dajú získať aj otlačky predmetov, napr. mincí. Namiesto
filtračného papierika je vhodnejšie pritom použiť elastickú látku ako je
celofán, fólia, pergamenový papier a pod. tento materiál sa celý namočí do
roztoku elektrolytu, najlepšie dusičnanu draselného a ešte vlhký sa
priloží a pritisne na predmet. Po expozícií sa celofán namočí do činidla
a nechá voľne vysušiť. Získajú sa pekné a zreteľné otlačky použitých
predmetov.
Elektrografické dôkazy vybraných kovov
Výber
kovov na elektrografickú analýzu v podmienkach školy zodpovedá ich výskytu
a používaniu v bežnom živote. Študent sa s týmito kovmi stretá
buď priamo alebo ako súčastí zliatin, prípadne minerálov. Na elektrografické
dôkazy vybraných kovov sa použijú čisté kovy, najznámejšie zliatiny kovov,
prípadne vhodné minerály. Ako činidlá na vlastné dôkazy sa vybrali také, ktoré
sú pomerne ľahko dostupné v školských laboratóriách. Tie činidlá, ktoré sú
citlivé pri reakciách v skúmavkách, na kvapkovacích doštičkách, prípadne
aj kvapkovaním na filtračných papieroch a zlyhávajú
u elektrografických analýz sa neuvádzajú. Rovnako sa neuvádzajú špeciálne,
drahé a citlivé činidlá používané v špecializovaných analytických
laboratóriách. Pre bežnú školskú prax sú pre vysoké náklady nedostupné aj
napriek tomu, že sú na elektrografické analýzy vhodné a použiteľné.
Záujemca ich popis a použitie nájde v každej učebnici kvalitatívnej
analytickej chémie.
Dôkaz železa
1.
Alkalické
hydroxidy a amoniak vyzrážajú hnedú zrazeninu hydroxidu železitého Fe(OH)3.
Na filtračnom papieriku vzniká hnedá škvrna. Pridaním kvapky zriedenej
minerálnej kyseliny (HCl, H2SO4, HNO3) sa
zrazenina rozpúšťa a škvrna zmizne.
2.
Tiokyanatan
draselný KSCN alebo tiokyanatan amónny NH4SCN v slabo kyslom
alebo neutrálnom prostredí dávajú so železitými iónmi krvavočervenú škvrnu na
exponovanom papieriku. Reakcia dôkazu je citlivá. Rušia prítomné maskovacie
činidlá, ako fluoridy, dusičnany, fosforečnany, vínany, oxaláty a ďalšie.
3.
Hexakyanoželeznatan
draselný K4[Fe(CN)6].3 H2O v neutrálnom alebo
slabo kyslom prostredí dáva modrú škvrnu tzv. Berlínskej modrej.
4.
Pyrokatechín
a ďalšie roztoky fenolov dávajú v kyslom prostredí so železitými iónmi farebné
roztoky, pri pH 1-2 zelenomodré, pH 3-5 modrofialové, pH 7 oranžovočervené.
5.
Kyselina
salicylová a jej deriváty v slabo kyslom prostredí reagujú s katiónmi Fe3+
za vzniku komplexných zlúčenín tmavočervenej farby. Po pridaní kvapky fluoridu
draselného KF farebná škvrna mizne. Vznikajú stabilnejšie komplexné zlúčeniny
železa s fluoridmi. Reakcia dôkazu je citlivá za neprítomnosti fluoridov a
fosforečnanov.
6.
Octan sodný
v neutrálnom prostredí dáva červený roztok. Pridaním kvapky minerálnej
kyseliny sa červená škvrna na exponovanom papieriku odfarbí.
Železo sa dá elektrograficky, okrem zliatin dokázať
aj v mineráloch magnetite Fe3O4, pyrite
a markazite FeS2, pyrhotíne Fe5S6,
chalkopyrite CuFeS2, bornite Cu5FeS4, stopy
železa v chalkozíne Cu2S, nikelíne NiAs3.
Dôkaz medi
1. Hexakyanoželeznatan
draselný, podobne ako u železa v neutrálnom a slabo kyslom
prostredí dáva s iónmi Cu2+ hnedú zrazeninu. Na papieriku sa
prejaví vznikom hnedej škvrny, nerozpustnej v minerálnych kyselinách,
rozpustnej v roztoku alkalických hydroxidov a v amoniaku. Dôkaz
ruší prítomnosť železitých iónov, ktoré za podobných podmienok dávajú modrú
škvrnu. Môže sa ale vhodným maskovacím činidlom eliminovať. Ovlhčený filtračný
papierik sa namočí alebo prikvapne roztok alkalického fosforečnanu alebo
alkalického fluoridu. Po expozícií vzorky sa prikvapne činidlo. Za prítomnosti
Fe3+ iónov vznikne modrá škvrna. Potom sa na túto škvrnu pridá
kvapka zriedenej kyseliny sírovej. Modrá škvrna zmizne, ak sú prítomné ióny Cu2+
vo vzorke objaví sa škvrna hnedej farby.
2. Amoniak dáva
s iónmi Cu2+ svetlomodrú škvrnu, ktorá po pridaní nadbytku
činidla sa mení na modrofialovú. Vzniká tetraamminmeďnatý komplex [Cu(NH3)4]2+,
z ktorého sa dá pridaním hexakyanoželeznatanu draselného získať hnedá škvrna.
3. Pôsobením alkalických
hydroxidov na exponovaný papierik vzniká svetlomodrá zrazenina hydroxidu
meďnatého Cu(OH)2. Miernym zahriatím nad plameňom kahana hnednie až
černie. Vzniká oxid meďnatý. Za prítomnosti kyselín(citrónová, vínna) sa
hydroxid nevyzráža, ale vzniká fialovomodrý roztok, na papieriku škvrna
uvedenej farby.
4. Jodid draselný KI, ktorý
sa kvapne na roztok Cu2+ iónov na papieriku dáva bielu zrazeninu
jodidu meďného Cu2I2. Postupne hnedne od
vylučovaného elementárneho jódu. Pridaním kvapky škrobového roztoku škvrna
zmodrie. Prikvapnutím roztoku sódy táto škvrna úplne zmizne. Dôkaz rušia
prítomné ióny železa.
Reakcie uvedených dôkazov medi sú vhodné na určenie
jej prítomnosti v zliatinách (bronz, mosadz) a mineráloch chalkozíne
Cu2S, covelline CuS, chalkopyrite CuFeS2, bornite Cu5FeS4,
tetredrite Cu3SbS3 a ďalších.
Dôkaz striebra
1. Zriedená kyselina
chlorovodíková HCl dáva bielu zrazeninu chloridu strieborného AgCl. Zrazenina
je citlivá na svetlo a biela škvrna na papieriku postupne fialovie až
černie v dôsledku prebiehajúcej fotochemickej reakcie rozkladu AgCl
a vylučovania striebra. Chlorid strieborný je nerozpustný
v zriedených minerálnych kyselinách, len v kyseline chlorovodíkovej
a koncentrovaných roztokoch alkalických chloridov. Rozpúšťa sa
v amoniaku, uhličitane amónnom (NH4)2CO3
a tiosírane sodnom Na2S2O3 za vzniku
stabilných komplexných solí.
2. Jodid draselný KI
vyzráža Ag+ ióny ako žltú zrazeninu, rozpustnú v tiosírane
sodnom Na2S2O3 a nadbytku jodidu.
Pridaním kvapky amoniaku na žltú škvrnu, obelie. Jodid strieborný sa nerozpúšťa
v zriedených kyselinách, ani v uhličitane amónnom (rozdiel od AgCl),
ani v koncentrovanom amoniaku.
3. Alkalické chrómany (K2CrO4,
K2Cr2O7) dávajú s Ag+ iónmi
červenohnedé zrazeniny. Škvrny tejto farby na papieriku po expozícií
a prikvapnutí činidla sa nemenia ani po pridaní koncentrovaného amoniaku,
ani v kyseline dusičnej.
4. Alkalické hydroxidy
(NaOH, KOH) dávajú hnedú zrazeninu, na papieriku škvrnu hnedej farby od
vylúčeného oxidu strieborného Ag2O. Rozpúšťa sa v amoniaku.
5. Uhličitan sodný, Na2CO3
.10 H2O vyzráža Ag+ ióny ako svetložltý uhličitan
strieborný Ag2CO3. Zrazenina sa zohriatím rozkladá a
hnedne od vylúčeného oxidu strieborného.
Uvedené reakcie dôkazov striebra sú vhodné na
identifikáciu strieborných predmetov, zliatin a minerálov, najlepšie
v argentite Ag2S, proustite Ag3SbS3,
stefanite Ag5SbS4 a ďalších vodivých minerálov
striebra.
Dôkaz olova
1. Chróman draselný K2CrO4
vyzráža žltú zrazeninu, nerozpustnú v kyseline octovej
a v amoniaku. Rozpúšťa sa v kyseline dusičnej a roztokoch
alkalických hydroxidov. Kvapnutím týchto činidiel sa papierik so škvrnou
chrómanu olovnatého PbCrO4 dochádza k jej rozpúšťaniu
a škvrna mizne.
Reakcia dôkazu olova chrómanmi je citlivá po dlhšej
expozícií vzorky. Ruší prítomné striebro, Ag+ ióny dávajú
hnedočervenú škvrnu.
2. Jodid draselný KI dáva
žltú zrazeninu jodidu olovnatého PbI2. Jodid draselný sa môže
kvapnúť na papierik. Pri expozícií vzniká okamžite žltá škvrna. Reakcia je
špecifická a citlivá zvlášť po dlhšej expozícií vzorky. Podobne reagujú
antimón a bizmut, ale na rozdiel od jodidu olovnatého ich jodidy sú
v horúcej vode nerozpustné.
3. Kyselina sírová reaguje
s iónmi Pb2+ za vzniku bielej zrazeniny. Na exponovaný papierik
sa kvapne kvapka zriedenej kyseliny sírovej. Na bielu škvrnu sa kvapne roztok
jodidu draselného. Vzniká intenzívne žltá škvrna PbI2. Olovnaté ióny
sa dokážu rovnako po pridaní na síran olovnatý PbSO4 chloridu
cinatého a jodidu draselného. Vzniká oranžovočervená škvrna zrazeniny 2
PbI2 . SnI2 .
Olovo sa dobre dokazuje v galenite PbS,
altzite PbTe. Menej citlivé sú dôkazy olova v mineráloch ako zinckenit
PbSb2S4, boulangerit Pb5Sb4S11,
burnonit PbCuSbS3 a v ďalších.
Dôkaz zlata
1. Chlorid cínatý SnCl2
(w = 10% v HCl c = 1 mol.dm-3) redukuje katióny Au3+
za vzniku tzv. Cassiovho purpuru (koloid zlata). Na filtračnom papieriku po
expozícií a pridaní činidla vzniká ružová až purpurová škvrna.
2. Síran anilínu (nasýtený
anilín v kyseline sírovej c = 1 mol . dm-3) dáva s iónmi
zlata modré až zelené zrazeniny. Reakciu dôkazu neruší prítomnosť iónov Ag+,
Pb2+, Cu2+.
3. Kyselina askorbová
redukuje Au3+ ióny. Po expozícií a pridaní činidla sa filtračný
papierik vysuší. Ružová až fialová škvrna je dôkazom prítomnosti zlata
v skúmanej vzorke. Dôkaz ruší prítomnosť striebra.
4. Mohrova soľ (NH4)2SO4FeSO4
. 6H2O je vhodná na dôkazy zlata v zliatinách
a mineráloch, napr. teluridoch. Na filtračný papierik sa kvapne kvapka
Mohrovej soli, priloží vzorka a exponuje. Po expozícií sa pridá ďalšia
kvapka činidla. Za prítomnosti zlata vzniká na papierikoch tmavá škvrna.
5. Benzidín (w = 0,1%
v 10% kyseline octovej) dáva za prítomnosti zlata vo vzorke škvrnu modrej
farby.
Popisované reakcie sa uplatnia pri dôkazoch zlata
v zliatinách, sylvanite AuAgTe4 a ďalších teluridoch.
Dôkaz antimónu
1. Sulfánom H2S
alebo sulfidom sodným Na2S z mierne kyslého prostredia sa
vyzráža oranžovočervený sulfid antimonitý Sb2S3,
nerozpustný v zriedených kyselinách. Elektrografický dôkaz sa uskutoční
najlepšie ak vzorka (minerál, kov, zliatina) sa namočí do zriedenej kyseliny
sírovej a exponuje dlhšie ako u iných kovov. Na vlastný dôkaz sa použije
sulfánová voda (nasýtený roztok sulfánu v destilovanej vode), alebo roztok
sulfidu sodného. U minerálov s malým obsahom antimónu, napr.
v tetraedrite dôkaz sulfánom zlyháva, je nepresvedčivý.
2. Tiosíran sodný Na2S2O3
. 5 H2O dáva s iónmi Sb3+ červenú zrazeninu, tzv.
antimónovú rumelku Sb2S3 . Sb2O3 .
Elektrografický dôkaz sa uskutoční nasledovným postupom. Na filtračný papierik
sa položí zrniečko činidla a prikvapne kvapka destilovanej vody.
Vzorka ovlhčená kyselinou chlorovodíkovou sa položí na činidlo a exponuje.
Po niekoľkých sekundách sa expozícia preruší. Vzniklá žltá škvrna sa mierne
zahreje nad plameňom kahana. Žltá škvrna sa zmení na oranžovú.
3. Tiomočovina sa za
prítomnosti iónov Sb3+ farbí na žlto. Ako základný elektrolyt sa
použije zriedená kyselina chlorovodíková. Na takto navlhčený papierik sa položí
zrniečko tiomočoviny. Po jej rozpustení sa exponuje.
4. Alkalické hydroxidy
dávajú žltohnedé škvrny na filtračnom papieriku po elektrografickej expozícií.
Na elektrografické
dôkazy antimónu sú okrem čistého antimónu vhodné minerály antimonit Sb2S3,
allemonit SbAs, tetraedrit Cu 3SbS3, pyrargyrit Ag3SbS3,
ullmanit NiSbS, zo zliatin napr. literina (tvrdé olovo), zliatina antimónu
s cínom (vyrábajú sa z nich jedálenské príbory) a ďalšie.
Dôkaz cínu
1. Sulfán (sulfánová voda)
dáva z mierne kyslého prostredia hnedý sulfid cínatý SnS,
u ciničitých iónov žltý sulfid ciničitý SnS2.
2. Chlorid železitý FeCl3
červenú škvrnu. Na exponovaný papierik sa kvapne kvapka roztoku chloridu
železitého (w = 3%) a kvapka Seignetovej soli (w = 10%). Za prítomnosti Sn2+
iónov vznikne červená škvrna. (Seignetova soľ C4H4O6KNa
. 4H2O – vínan sodnodraselný, nasýtený roztok)
3. Metylénová modrá (w =
0,01% roztok v HCl c = 1 mol . dm-3) sa za prítomnosti Sn2+
iónov odfarbuje. Na filtračný papier sa kvapne indiferentný elektrolyt
a činidlo. Po expozícií v miestach dotyku vzorky s metylénovou
modrou sa modrá farba odfarbuje.
4. Chlorid ortutnatý
a anilín. Filtračný papierik sa nasýti koncentrovaným roztokom chloridu
ortutnatého a exponuje. Potom sa prikvapne kvapka anilínu. Za prítomnosti
katiónov Sn2+ vznikla čierna škvrna.
Popisovanými roztokmi sa
dokáže prítomnosť cínu v zliatinách napr.
bielom plechu, v pájke
(obsahuje 40-70% Sn a 60-30% Pb). Cín sa dokáže aj v mineráloch napr.
cínovci SnO2, kolbeckíne Sn2S3, staníne Cu2FeSnS4
a ďalších sulfidoch cínu.
Dôkaz kobaltu
1. Dusitan draselný KNO2
z prostredia okysleného kyselinou octovou vyzráža žltú zrazeninu,
rozpustnú v minerálnych kyselinách. Na filtračný papierik sa kvapne dusitan
draselný alebo kyselina octová a dlhšie exponuje. Potom sa pridá zrniečko
dusitanu draselného a kvapka kyseliny octovej, po chvíli vzniká žltá
škvrna.
2. Sulfán (sulfánová voda)
alebo sulfid amónny z neutrálneho roztoku kobaltových solí vyzrážajú
čierny sulfid kobaltnatý CoS. Z kyslých roztokov zrazenina nevzniká.
Acidita sa otupí octanom sodným. Na filtračný papierik po expozícií sa kvapne
octan sodný a činidlo. Čierna škvrna identifikuje prítomnosť kobaltu
v analyzovanej vzorke.
3. Alkalické hydroxidy
dávajú modrú zrazeninu hydroxidosolí kobaltu. V nadbytku činidla modrá
farba prechádza na ružovú, ktorá postupne hnedne. Reakcia sa urýchli pridaním
kvapky peroxidu vodíka H2O2 (w = 3%).
4. Tiokyanatan draselný
dáva modré roztoky. Na filtračný papier sa kvapne kvapka činidla KSCN (w = 1%)
a exponuje. Za prítomnosti kobaltu vo vzorke vzniká modrá škvrna, ktorá po
pridaní kvapky vody mizne. Opatrným vysušením nad plameňom kahana sa opäť
objaví.
Kobalt sa elektrograficky dokáže
v kobaltíne CoAsS, glaukodote (Co2Fe)AsS, linneite Co3S4,
stopy kobaltu aj v pyrhotíne FeS.
Dôkaz niklu
1. Diacetyldioxim je
najcitlivejším činidlom na dôkaz niklu. Na filtračný papierik sa kvapne
nasýtený roztok hydrogenfosforečnanu sodného Na2HPO4
(maskovacie činidlo, viaže rušiace katióny). Po expozícií sa prikvapne činidlo
diacetyldioxim a odymí amoniakom. Už za prítomnosti stôp Ni2+
iónov škvrna ružovie. Reakcia je špecifická a dôkaz citlivý len
v neutrálnom alebo alkalickom prostredí. Za prítomnosti iónov Cu2+,
Co2+, Fe2+, ktoré nerušia, ale znižujú citlivosť dôkazu
sa postupuje nasledovne.. Po expozícií sa kvapne na filtračný papierik peroxid
vodíka, ktorý oxiduje ióny Fe2+ na Fe3+ a Co2+
na Co3+. Pridá sa kvapka nasýteného roztoku vínanu sodného na
zamaskovanie katiónov Fe3+. Po prikvapnutí amoniaku sa vytvoria
nerozpustné zrazeniny Co(OH)3 a Cu(OH)2, splachnú sa
vodou a po odymení modrej škvrny amoniakom sa pridá diacetyldioxim
a dokazuje prítomnosť niklu.
2. Amoniak dáva
s iónmi Ni2+ zelenú zrazeninu, ktorá pridaním nadbytku činidla
prechádza na modrofialovú škvrnu amminkomplexu niklu.
3. Alkalické hydroxidy
vyzrážajú hydroxid nikelnatý Ni(OH)2 zelenej farby. Zrazenina
nevzniká za prítomnosti organických kyselín (vinná, citrónová a ďalšie).
Ióny Ni2+ sú maskované.
4. Dekahydrát uhličitanu
sodného (w = 10%) vyzráža Ni2+ ióny ako zelenú zrazeninu
hydroxidosolí. Pôsobením uhličitanu amónneho sa zrazenina rozpúšťa na modrý
uhličitan hexaamminnikelnatý [Ni (NH3)6]CO3.
Dôkaz síry
Síra sa môže elektrograficky dokazovať vo všetkých
sulfidoch. Filtračný papierik sa ovlhčí octanom sodným (w = 10%)
a exponuje v opačnom zapojení zdroja prúdu. Vzorka je katóda,
hliníková platnička anóda. Po expozícií sa papierik ovlhčí roztokom octanu
olovnatého (w = 10%). Za prítomnosti síry vo vzorke sa vylúči čierny sulfid
olovnatý PbS, vzniká čierna škvrna.
Prítomnosť sulfidov
sa dá overiť pridaním zriedenej kyseliny chlorovodíkovej a kademnatej soli,
napr. octanu kademnatého, dusičnanu kademnateého a pod. Vznikne žltá
škvrna sulfidu kademnatého CdS.
Literatúra:
1.
TOMEČEK,
O.: Kvalitatívna chemická analýza. Banská Bystrica : FPV, 2000. 239 s.
ISBN 80-967826-8-1
2.
TOMEČEK,
O.: Chemické rozbory minerálov na ZDŠ a SVŠ. In: Sborník pedagogického
inštitútu v Martine III. Bratislava : SPN, 1966. s. 165-180.